27/10/20
28/9/20
TERMOQUÍMICA : ejercicio resuelto con LEY DE HESS
Video con la explicación de un profesor español. El único comentario que haría es que la reacción c) no se multiplica por (-1) sino que se trata de la reacción INVERSA y se aplica la Ley de Lavoisier-Laplace: la entalpía de formación de un compuesto es igual numéricamente pero de signo contrario que la entalpía de descomposición del mismo.
ejercicio resuelto con LEY DE HESS
TERMOQUIMICA : ejercicio resuelto con sumatoria de ENTALPÍAS DE FORMACIÓN
Este video es de un profesor español que explica bien y es divertido.
17/9/20
TERMOQUÍMICA : Calorimetría de la neutralización ácido-base
La neutralización de ácido clorhídrico e hidróxido de sodio es exotérmica y se desea conocer el calor liberado en el proceso de neutralización.
Se parte de dos soluciones de igual concentración molar del ácido y de la base. Se medirá el calor liberado a presión constante (QP) con un CALORÍMETRO de laboratorio o casero.
Técnica : Partir del equilibrio térmico de las soluciones y el calorímetro (todos a la misma temperatura inicial). De esa manera se puede despreciar la capacidad calorífica del calorímetro (pérdidas por paredes, termómetro y agitador). Todo el calor liberado en la neutralización se verá reflejado en el aumento de temperatura. En este punto se mide TEMPERATURA INICIAL.
En el calorímetro se mezclarán volúmenes iguales del ácido y de la base, medidos previamente con probeta, por ejemplo 100 mL de cada uno. Se agita bien. La temperatura se eleva a un valor máximo que es la TEMPERATURA FINAL.
Video
Calor de neutralización de las soluciones de ácido y base
Cálculos
Q = masa de las soluciones x calor específico de las soluciones x variación de temperatura
Se realiza la siguiente aproximación : Las soluciones son tan diluídas que su densidad puede considerarse igual a la del agua (1 g/mL) o sea que si se agregaron 100 mL de ácido y 100 mL de base y consideramos esos volúmenes como aditivos, se tienen 200 mL o sea 200 g .
De la misma manera se considerará que el calor específico de cada solución es igual al calor específico del agua, que es 1 cal/g ºC.
Si por ejemplo se obtuvo una diferencia de temperatura de unos 6 grados, se tiene:
Q= 200 g x 1 cal/gºC x 6,0ºC = 1200 cal
- - Si se desea conocer el valor en Joule, la conversión que aplica es que 1 cal equivale a 4,18 J
- - Si se desea conocer la variación de entalpía de la reacción
HCl (ac) + NaOH (ac) --> NaCl (ac) + H2O
debe tenerse en cuenta que el calor absorbido por la mezcla y su aumento de temperatura provienen de la liberación del calor de neutralización. Es decir que, desde el punto de vista de la reacción química es una pérdida. La variación de entalpía de la neutralización tiene signo NEGATIVO.
-- Si se desea conocer la ENTALPÍA MOLAR de neutralización, puede hacerse el cálculo de la cantidad de sustancia (en mol) involucrada en el experimento.
29/7/20
25/6/20
¿Cómo hacer jabón con aceite reciclado?
Se necesita:
3 L de aceite usado previamente filtrado
3 L de agua con 500 g de soda cáustica
puede utilizarse un aromatizador
15/6/20
Selección de aceites y grasas en nuestra alimentación
FAO : aceites para freir y para ensaladas y otros productos
FAO es la organización para la alimentación y agricultura que pertenece a las Naciones Unidas, una estructura supranacional. Es una sigla en inglés : Food and Agriculture Organization.
Para ampliar información nutricional está el MANUAL DE LA FAO del 2012 : aquí
29/4/20
¿Estructura pentanaria?
tips de la TAREA 14
- La ruptura TOTAL con separación de todos los residuos de aminoácidos se logra hirviendo el péptido 2 horas con HCl 6M (el concentrado, al medio).
- La ruptura por secciones se realiza mediante la degradación de EDMAN.
28/4/20
TAREAS 9 a 13
- La primera que para calcular el punto isoeléctrico pI en casos de 3 valores de pK de todas maneras se utilizan sólo dos para la media aritmética : los valores de pK anterior y posterior al zwitterion.
- La segunda es que en el anillo imidazol de la Histidina hay mayor densidad electrónica sobre el átomo de N unido por enlace doble a C (se llama imino C=N) que sobre la amina secundaria que es el otro N. Es en el N imínico donde se protonará. En el caso de la Arginina el razonamiento es similar.
19/4/20
PROTEÍNAS en 5 min ! para ver 50 veces :)
minuto
|
Comentario
|
TAREA 14
|
| 0:00 |
Las proteínas son polímeros naturales de
a-L-aminoácidos.
|
1) Busque los
conceptos de polímero y monómero.
2) Repase el
significado de los descriptores alfa y L.
|
| 0:42 |
Debió decir cadena lateral R o sustituyente R
del C-alfa.
RADICAL para Química tiene otro significado. Los
radicales son especies químicas -que participan justamente en
“reacciones radicalarias”- con número impar de electrones.
Son reacciones muy específicas y no es correcto utilizar en este
caso.
Tampoco parece apropiado utilizar la denominación
RAMIFICACIÓN porque no se trata de una cadena que no es normal,
puede serlo y estar sustituyendo al C-alfa.
|
|
| 0:54 |
No es una donación. Y se pierde sólo una molécula de agua.
Es una reacción química de condensación
con pérdida de agua, que ocurre en el citoplasma celular a nivel
de los organelos llamados ribosomas y está mediado por enzimas.
|
|
| 1:07 |
Nomenclatura incorrecta.
El nombre del dipéptido es valinilalanina.
|
3) Nombre los
tripéptidos Ala-Leu-Lis y Lis-Ala-Leu.
4) ¿Importa el
orden en que están unidos los residuos de estos 3
aminoácidos?
Si tiene dudas : formule
ambos y compare.
|
| 1:21 |
Debió decir que están unidos por enlace
covalente con 40% carácter de doble enlace. Lo hemos visto antes
en este BLOG, estudiando las características del enlace
peptídico.
|
|
| 2:09 |
No queda claro en el video que los responsables de la
estructura secundaria sean puentes de hidrógeno entre enlaces
peptídicos de la misma o diferentes cadenas de péptidos.
|
5) Repasar el
concepto de ENLACE DE HIDRÓGENO.
¿Es correcto decir enlace
o decir puente de hidrógeno o nos acostumbramos por el uso?
6) Justifique por
qué se produce en el caso particular de dos enlaces peptídicos
entre si.
|
| 2:32 |
Error cuando describe
láminas antiparalelas.
Una está en sentido amino-terminal hacia
carboxi-terminal (N => C) y la otra al revés: sentido
carboxi-terminal a amino-terminal (C => N). Por eso son anti
paralelas, distintos sentidos.
|
|
| 3:40 |
La lámina debería titular : “entre cadenas
laterales R de los residuos de aminoácidos”
|
|
| 3:52 |
Diversos enlaces entre cadenas laterales R de los
residuos de aminoácidos son responsables de la estructura
terciaria.
|
7) Haga un lista de
enlaces responsables de la estructura terciaria de una proteína
acompañada de ejemplos.
|
| 3:52 |
Todos los enlaces mencionados entre cadenas
laterales R tienen distintas características (fuerza de enlace,
longitud, frecuencia). En particular los puentes disulfuro entre
residuos de cisteínas son estratégicos aunque en promedio
aparecen unas 3 veces por péptido.
|
8) En el BLOG se
dejó la reacción redox de formación de la cistina. Identifique
oxidante y reductor en la reacción de formación de cistina.
|
| 4:00 |
La conferencista terminó de describir la
estructura terciaria de proteínas sin hablar de Dominios y
de Loops.
|
9) Busque
información sobre dominios y loops y su importancia a nivel
funcional.
|
| 4:16 |
Las estructuras terciarias que participan de una
estructura cuaternaria se llaman subunidades. Pueden ser
iguales o diferentes (homo/heteroproteínas).
|
10) Defina grupo
prostético y cite un ejemplo.
|
| 4:27 |
Está incompleta la lista de agentes físicos y
químicos que producen desnaturalización de una proteína.
|
11) Haga la lista de
agentes desnaturalizantes. Cite ejemplos de cocina.
|
| 4:27 |
En la desnaturalización se pierde niveles
estructurales superiores pero se conserva la estructura primaria
de una proteína. Los residuos de aminoácidos continúan unidos.
|
Busque las reacciones de
separación de los residuos de aminoácidos :
12) separación
total,
13) degradación de
EDMAN.
|
| 4:30 |
La desnaturalización, ¿ implica la pérdida
definitiva de la estructura nativa de una proteína o puede
haber renaturalización ?
|
14) Si se puede dar
la renaturalización, busque un ejemplo.
|
| 4:36 |
15) Dibuje y describa al
detalle la estructura del Colágeno.
Ubique su nivel estructural
en los niveles que acaba de conocer.
|
15/4/20
EL ENLACE PEPTÍDICO
Enlace covalente entre residuos de aminoácidos para formar péptidos. A nivel celular su formación es catalizada enzimáticamente y acoplada a la hidrólisis de una molécula de ATP ya que no es favorable la reacción (posee un deltaG >0). Pero es una reacción sencilla con pérdida de agua y formación de una amida NH-C=O a la que llamamos simplemente enlace peptídico.
Lista de pK de aa y su aplicación
14/4/20
Para complementar la TAREA 8 (2da parte)
Pensemos en general, una cadena lateral R que tiene un segundo -COOH
Siempre chequear, no son cosas para aprender de memoria !
Para complementar la TAREA 8 (1ra parte)
Para complementar las TAREAS 5-6-7
31/3/20
Los alfa-aminoácidos y el pH del medio
Espero que les haya llamado la atención el hecho de que los ejemplos muestran la migración de un protón (catión H+) del grupo carboxilo al grupo amino en posición C-alfa. No se ve -COOH y -NH2 !!
Es una reacción ácido-base interna. Las aminas son las bases de la Química Orgánica, el par de electrones sobre el átomo de nitrógeno atrae al hidrógeno lábil del grupo carboxilo que migra, dejando por esa razón anión carboxilato (-COO-) y catión amonio (-NH3+). En la figura siguiente es la estructura central, llamada ZWITTERION o también IÓN DIPOLAR porque lleva una carga positiva sobre el N y una carga negativa sobre O, como se puede calcular la carga neta es nula q neta = 0 para esta especie.
El medio muy ácido proveería de catión H+ externo, que será atraído por el carboxilato (-COO-) neutralizándolo y obteniéndose carboxilo (-COOH) en su lugar. La carga total ahora es q = +1 (fórmula de la izquierda) por lo que se llama ESPECIE CATIÓNICA del alfa-aminoácido.
El medio básico producirá el efecto contrario, quitando el protón (H+) que estaba sobre el átomo de nitrógeno. Por supuesto no tiene efecto sobre la carga negativa del oxígeno. Total que la carga neta de la fórmula de la derecha es q = -1 por eso se llama ESPECIE ANIÓNICA del alfa-aminoácido.
Estas reacciones constituyen EQUILIBRIOS QUÍMICOS, dependientes además de la temperatura de las soluciones. Como en toda situación de equilibrio, todas las especies involucradas están presentes aunque sea en un mínimo porcentaje. Quiere decir que variando el pH del medio es posible obtener mayor concentración de la especie catiónica o del zwitterion neutro o de la especie aniónica, pero NO podríamos decir que exclusivamente una de ellas.
Es muy interesante el experimento de electroforesis. Una solución del aminoácido preparada a determinado pH migra hace uno de los electrodos de un campo eléctrico. Si se prepara a otro pH puede migrar al otro electrodo o no migrar !
En esta figura se observan varias gotas de diferentes alfa-aminoácidos en un extrema de la placa de apoyo. Se observará su migración hacia el polo positivo. Las constantes de equilibrio ácido-base de las cambios estudiados son todas distintas según qué aminoácido sea. Por eso aunque el punto de partida sea el mismo, el movimiento en un campo eléctrico será diferenciado.
El PUNTO ISOELÉCTRICO es el pH de la solución del aminoácido en que no se produce migración hacia los electrodos de un campo eléctrico. A ese pH también se cumple -es la razón de lo anterior- que la especie mayoritaria presente es el zwitterion.
TAREA 8. Hay dos alfa-aminoácidos "ácidos" : ácido aspártico y ácido glutámico. Y tres alfa-aminoácidos "básicos" : lisina, arginina, histidina. Las cadenas laterales de todos ellos contienen un grupo funcional EXTRA. Observe que aspártico y glutámico tienen un nuevo carboxilo (-COOH) en sus cadenas laterales; los otros tres tienen grupo amino (-NH2) extra en ellas. Eso genera nuevos equilibrios ácido-base según el pH.
Su tarea es buscar el diseño completo de los equilibrios ácido-base a distintos pH (como lo hicimos antes) para la lisina y el ácido aspártico. Estableciendo sus especies catiónicas y aniónicas y hallando el zwitterion. Busque los datos numéricos de pH de los dos zwitteriones.
¿Cómo funciona un POLARÍMETRO?
Interior de un Polarímetro
CÓMO SE UTILIZA
QUÉ SE VE POR EL VISOR
El tubo interior o tubo de la muestra contiene una sustancia pura o bien una solución de la sustancia en estudio. La densidad de la sustancia o la concentración de la solución, así como su temperatura, deben ser conocidas/controladas porque mostrarían variaciones en los resultados. Asimismo si el largo del tubo (trayectoria o camino óptico que realizará la luz polarizada atravesando el tubo de muestra) no fuese de 2 dm como es habitual. También depende de la longitud de onda de la luz utilizada.
El ángulo de rotación alfa de la luz polarizada se indica en grados. Está estandarizado para la longitud de onda de la línea D amarilla de lámpara de sodio que es 589 nm, temperatura de 20ºC, contenido del tubo concentración de un g/mL.
La rotación específica es una constante física de una sustancia ópticamente activa. Si fuese otra la situación, habría que hacer las respectivas correcciones.
Isomería óptica de alfa-aminoácidos
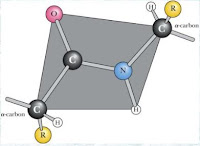
El C-alfa de los alfa-aminoácidos es un C-quiral, está unido a 4 sustituyentes diferentes.
Como consecuencia, existe su imagen especular (imagen en el espejo, simbolizada por la línea punteada) y se observa que no es "superponible". No superponible quiere decir que, aunque coincidan las esferas central/arriba/abajo no van a coincidir las esferas derecha/izquierda. Ésto sucede con sus dos manos, en el espejo se enfrentan, al poner una sobre otra se ve que son opuestas.
COMPUESTOS CUYAS ESTRUCTURAS SON IMÁGENES ESPECULARES NO SUPERPONIBLES SE LLAMAN ENANTIÓMEROS. Delante de su nombre debe indicarse (+) o (-) según sea el enantiómero correspondiente.
TAREA 7. Además de la actividad óptica, ¿qué otras propiedades físicas y químicas tienen los alfa-aminoácidos?
¿Qué es un alfa-aminoácido ?
Es un compuesto que posee ambos grupos funcionales : amina (-NH2) y carboxilo (-COOH). En particular, los alfa-aminoácidos dan origen a proteínas;siendo el C-1 el mismo grupo carboxilo (-COOH) decimos que su C-vecino es C-alfa y allí debe encontrarse el grupo amino (-NH2). Observe que todos los alfa-aminoácidos presentan la misma estructura en extremo de cadena pero difieren en las cadenas laterales, que llamamos genericamente "cadenas -R"
Existen muchos aminoácidos que no son alfa-aminoácidos pero no los estudiaremos porque no formarán parte de proteínas...
TAREA 5. Infórmese sobre la fórmula y la importancia del neurotransmisor GABA. Conserve ese ejemplo de una aminoácido que NO es alfa.
Como la única diferencia entre los alfa-aminoácidos formadores de proteínas son sus cadenas laterales, es de suma importancia observar y clasificar esas cadenas de acuerdo a sus propiedades. Ellas influyen en el contacto del aminoácido con su entorno !
Hay cadenas laterales no cargadas pero polares porque en las cadenas laterales poseen nuevos grupos funcionales que le dan esa característica, por ej.: es el caso de serina y treonina.
Hay cadenas laterales cargadas electricamente a ciertos valores de pH (son positivas o son negativas) y se clasifican como aminoácidos ácidos o aminoácidos básicos, por ej. es el caso del ácido aspártico o de la lisina y otros. Hay cadenas laterales hidrofóbicas como en la leucina, o aromáticas como en el triptofano, etc.
TAREA 6. Vea la siguiente figura para citar todos los ejemplos de todas esas categorías distintas de alfa-aminoácidos, escribiendo el nombre del alfa-aminoácido con el sistema de 3 letras y su fórmula.